Parkinson-Erkrankung: Wenn der molekulare Wächter bewacht werden muss
Neuer Ansatzpunkt gegen die Parkinson-Erkrankung: Forschungsteam der Universität Konstanz zeigt Rolle des Proteins FAT10 bei der Entstehung der Krankheit auf.
Die Parkinson-Erkrankung ist die zweithäufigste altersbedingte, neurodegenerative Krankheit: Allein in Deutschland sind rund 300.000 Menschen davon betroffen und leiden unter teils deutlichen Einschränkungen ihrer Lebensqualität. Trotz der hohen Verbreitung gibt es gegenwärtig noch keine Therapie, welche die Parkinson-Erkrankung in ihren Ursachen bekämpft und dauerhaft stoppt.
Aktuelle Forschungsergebnisse machen jedoch Hoffnung: Ein Forschungsteam der Universität Konstanz unter Federführung von Prof. Dr. Marcus Groettrup schildert einen neuen Ansatzpunkt für die Entwicklung künftiger Parkinson-Therapien. Die Biologinnen und Biologen wiesen nach, dass das ubiquitinartige Protein FAT10 im Gehirn die molekularen Abwehrmechanismen gegen die Parkinson-Erkrankung hemmt. Der biochemische Mechanismus ist reichlich perfide: FAT10 sorgt dafür, dass unser molekularer „Wächter“ gegen die Parkinson-Erkrankung – das Enzym Parkin – durch die körpereigenen Prozesse abgebaut wird. Anstatt beschädigte Mitochondrien in Gehirnzellen zu entsorgen, wird der Wächter selbst vom Körper abgebaut. Die Forschungsergebnisse werden heute, 16. März 2021, im Wissenschaftsjournal Cell Reports veröffentlicht.
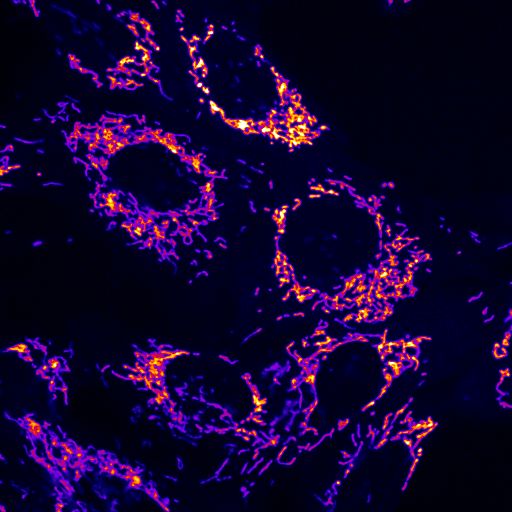
Geschädigte Kraftwerke der Zelle
Die Parkinson-Erkrankung entsteht durch das Absterben von Nervenzellen im Mittelhirn. Die Ursache hierfür liegt in der mangelnden Entsorgung von geschädigten Mitochondrien, den „Kraftwerken der Zelle“. Wenn defekte Mitochondrien nicht vom Körper abgebaut werden, entstehen sogenannte Sauerstoffradikale im Gehirn, die wiederum die Nervenzellen schädigen und zu deren Zelltod führen.
Damit Mitochondrien vom Körper abgebaut werden können, müssen sie zunächst durch einen Signalstoff markiert werden. Das ist vergleichbar mit einem Etikett mit der Aufschrift „Defekt – bitte wegwerfen“, das an einem ramponierten Gegenstand angebracht wird. Für die Etikettierung von geschädigten Mitochondrien ist das Enzym Parkin zuständig. Die molekularen Etiketten, die es an sie anheftet, bestehen aus dem Protein Ubiquitin.
Falsch etikettiert
An dieser Stelle kommt das Protein FAT10 ins Spiel. FAT10 ist Ubiquitin in seiner Struktur und seiner Funktion sehr ähnlich: Es ist ebenfalls ein Signalstoff, der andere Moleküle für den Abbau markiert. Leider sorgt FAT10 im Fall der Mitochondrien für einen Etikettenschwindel: Es etikettiert nicht nur die geschädigten Mitochondrien, sondern auch das Enzym Parkin für den Abbau durch die körpereigenen Prozesse.
Bildlich gesprochen bedeutet dies: An den Wächter im Inneren der Zelle, der beschädigte Mitochondrien für die Entsorgung etikettiert, wird selbst ein Etikett angebracht – und er wird durch den Körper entsorgt. Je mehr dieser Wächter entsorgt werden, desto weniger defekte Mitochondrien können von ihnen korrekt markiert werden. Die Folge: Geschädigte Mitochondrien werden von den Abwehrprozessen des Körpers übersehen, bleiben übrig – und schädigen auf Dauer die Hirnzellen.
„Wir hoffen, mit dieser Entdeckung einen neuen Ansatzpunkt für die Entwicklung einer wirkungsvollen Therapie der Parkinson-Erkrankung aufzuzeigen. Ein Hemmstoff für FAT10 könnte potenziell eingesetzt werden, um den Abbau von Parkin zu verhindern und dafür zu sorgen, dass geschädigte Mitochondrien korrekt abgebaut werden“, schildert Marcus Groettrup.
Die Forschung unter maßgeblicher Beteiligung von Nicola Roverato, Erstautor und Doktorand in der Arbeitsgruppe von Marcus Groettrup, fand im Rahmen des Sonderforschungsbereiches SFB 969 „Chemische und biologische Prinzipien der zellulären Proteostase“ statt.
